Enzimlerle ilgili oldukça uzun bir yazı hazırlarken, tütün sapları ile yapılan iki araştırma oldukça ilgimi çekti. Bu yüzden fazla bekletmeden yazmaya karar verdim. Önce bu ki araştırmadan kısaca özet yaparak, enzim konusuna ayrıntılı bir giriş yapalım.
Ondokuz Mayıs Üniversitesi, Ziraat Fakültesi, Toprak Bölümü Öğretim Üyeleri Doç. Dr. Nutullah ÖZDEMİR - Dr. Rıdvan KIZILKAYA - Araş. Gör. Abdulkadir SÜRÜCÜ tarafından yapılan bir araştırmada, elde edilen sonuçlara göre, topraklara uygulanan tütün fabrikasyon atığı çeltik sapı, fiğ ve tavuk gübresi üreaz aktivitesini önemli düzeyde, şlempe ise önemsiz düzeyde artırmıştır. Organik atıkların üreaz aktivitesi üzerinde sağladığı artış aşağıdaki şekilde sıralanabilir.
Tütün fabrikasyon atığı> Tavuk gübresi > Fiğ > Çeltik sapı > Şlempe şeklinde sıralanmıştır.
Ankara Üniversitesi Ziraat Fakültesi tarafından tapılmış (Rıdvan KIZILKAYA, İmanverdi EKBERLİ, Nalan KARS) Tütün Atığı ve Buğday Samanı Uygulanmış Toprakta Üreaz Aktivitesi ve Kinetiği isimli çalışmada ise, Tütün Atığının üreaz enzim aktivetsini daha kısa sürede artırdığı tespit edilmiştir.
Bitki gelişimi için bu kadar önemli olan enzimler nedir ne değildir? Aşağıdaki yazı umarım kafalardaki soru işaretlerini bir nebze olsun giderir. Yazının hazırlanmasında Prof. Koray Haktanır ve Prof. Sevinç Arcak'ın Toprak Biyolojisi kitabından, Yrd.Doç.Dr. Ali COŞKAN'ın Toprak Biyolojisi ders notlarından, Biyotar web sitesinden yararlanılmıştır.
Enzimler
Yaşayan maddenin en dikkat çekici özelliklerinden biri, son derece çeşitli ve karışık kimyasal reaksiyonları büyük bir hızla gerçekleştirmek gücünde olmasıdır. Mevcut teknolojik olanaklarla bu olayları yapmak güç veya olanaksız olduğu halde, yaşayan hücre bu reaksiyonları son derece kolaylıkla yürütmektedir. Yaşayan organizmada bütün
biyokimyasal ve biyolojik olayları yapan, enzim adı verilen maddelerdir. Bütün bu olaylarda enzimlerin yaptıkları tesir şekli, kimyayasal reaksiyonlardaki
katalizörlerin aynıdır. Zira reaksiyona katıldıkları ve kendilerinden bir şey sarfedilmediği halde enzimler bu reaksiyonları çabuklaştırır ve teşvik ederler. Bu nedenle enzimleri
organik katalizör veya biyokatalizör olarak adlandırmak mümkündür. Enzim adını ilk olarak 1878 yılında Kühne kullanmıştır. Enzimler, hücre stoplazmalarında, mitokondrilerde bulunmakta ve özelliklerini hücre çeşidine göre kromozomlar tayin etmektedir. Yaşayan hayvansal veya bitkisel organizmaların hücrelerinde organizmaya göre çeşitli enzimler bulunmakta, hücre veya organizmanın yaşamsal işlevleri için gerekli bütün kimyasal reaksiyonlar enzimler tarafından yürütülmektedir.
Enzimler bütün madde değişimi reaksiyonlarına katılırlar ve enzimsiz hayat olayları oluşamaz. Özet olarak denilebilir ki enzimler, organizmadan elde edilebilen fakat faaliyet göstermeleri için organizmaya ihtiyaç göstermeyen
yüksek moleküllü katalizörlerdir. Enzimlerin başlıca görevi, yüksek moleküllü organik maddeleri basit, yani hücreye geçebilecek ve neticede organizma tarafından yararlanılabilecek şekle sokmaktır. Başta da belirtildiği gibi enzimler katalizör olarak ve sadece mevcudiyetleriyle, reaksiyonların daha hızlı oluşumunu sağlarlar. Örneğin proteinleri, kimyasal yollarla aminoasitlere hidrolize etmek için 108 derecede % 20 lik hidroklorik asitle 24 saat kaynatmak gerekirken, sindirim enzimleri aynı işi çok hafif konsantrasyondaki hidroklorik asitle 4 saat içinde gerçekleştirirler.
Son araştırmalara göre, enzimlerin büyük bir kısmı iki unsurdan oluşmuştur. Sistemin birinci kısmını büyük bir protein molekülü oluşturur ki buna
apo-enzim veya feron adı verilir. İkincisi daha küçük buna
ko-enzim veya
agon adı verilir. İkinci kısmın proteine olan bağı çok gevşektir. Her iki kısım birden
holo-enzim teşkil ederler. Bu gibi enzimler bir çeşit
proteid olarak kabul edilebilirler (proteidler gerçek protein olmayan unsurlardan ibaret bileşiklerdir). Şayet bu iki unsurdan birisi ayrılacak olursa enzim tesirini kaybeder, bir araya getirildiklerinde tekrar tesirini kazanır. Apo-enzim protein olduğundan, ısıya karşı dayanıksızdır, ko-enzimi taşıma ödevini görür ve sistemin özelliklerini tayin eder. Ko-enzim ise protein karakterinde olmadığından ısıya karşı dayanıklıdır apo-enzim sürekli bir ko-enzimi taşımaz, başka bir koenzimi de taşıyabilir. Bazı enzimlerde aktivatörlüğü, vitaminler veya özel gruplar yapmaktadırlar.
Bu nedenle bir vitamin bir dereceye kadar koenzim de sayılabilir. Bazı enzimler vardır ki bir enzim sisteminden oluşmuştur, yani içinde birçok enzim bireyleri bulunmaktadır.
Enzimler her organizmada, muhtelif organlara değişik şekillerde dağılmış durumdadırlar. Aynı familyadaki mikroorganizmalar dahi, değişik miktarlarda farklı enzim bulundururlar. Bazı enzimler, enzimatik faaliyette bulunabilmek için mutlaka bazı anorganik bileşiklere ihtiyaç gösterirler, bu bakımdan en önemli rol
oynayan anorganik unsurlar, çeşitli metal iyonlarıdır. Böylece
mangan, magnezyum, demir, bakır, çinko ve potasyum gibi metal iyonları proteinden oluşmuş metal-enzim sistemlerini oluşturmaktadır. Kendilerine özgü reaksiyonları yapabilmeleri için, yapılarında metal iyonlarına ihtiyaç gösteren enzimler üç gruba ayrılmaktadır.
1. Enzimin aktif kısmında tesir edici unsur rolunü oynayan metali içeren metal enzimler olup,
katalaz, peroksidaz, sitokrom enzimleri bu gruba girerler. Demir ve bakır metalleri bu grup için önemlidir.
2. Yapısındaki metal iyonu doğrudan doğruya tesir edici olan, yani Koenzim rolü oynayan metal enzimlerdir. Bunlardaki
metal, çinko ve bakırdır (Bir çok oksidazlarda olduğu gibi).
3. Yapılarında bulunan metaller az çok
dissosiye (Bir bileşiğin sıvı durumda kendisini oluşturan pozitif ve negatif yüklü iyonlarına ayrışmasıdır. Suyun H+ ve OH- iyonlarına ayrışması gibi.) olabilen metal enzimler olup, bu grup enzimlerdeki metalin yerini diğer bir metal alabilmektedir,
fosfatazlarla, karboksilaz ve enolazda olduğu gibi.
Enzimler yaşayan hücreler tarafından oluşturulmakla birlikte, yararları bakımından her zaman hücreye bağlı değildirler. Bu nedenle çoğu hücreye bağlı olmakla birlikte, bazıları da hücreden ayrılabilir, yani ortama salgılanabilirler.
Enzimler oluştukları hücrelerin içinde ve dışında ödev görmelerine göre
Endo ve Ekto enzimler olmak üzere iki gruba ayrılmaktadırlar. Oluştukları hücrelerde cereyan eden çeşitli biyokimyasal reaksiyonları katalizleyen enzimlere
endo enzim adı verilmektedir. Hücrelerin, hücre dışındaki absorbe edemiyecekleri kadar büyük moleküllü besin maddelerini parçalamak için dışarıya saldıkları enzimlere de
ekto-enzim adı verilmektedir. Bu enzimler ortama geçerek tesirlerini gösterip yüksek moleküllü maddeleri parçalayarak, bunları hücre membranından (geçirgen zar) içeriye geçecek şekle sokarlar. Toprak enzimolojisinin ağırlık merkezini ekto-enzimler ve bunların katalizledikleri reaksiyonlar teşkil etmektedir.
Enzimler parçalama yaptıkları gibi sentez de yapmaktadırlar, yani enzimlerin büyük bir kısmı
reversbl etkiye sahiptir. Parçalayabildikleri bileşikleri, parçalanma ürünlerinden tekrar sentez de edebilirler. Sentez yapan enzimler bilhassa metabolizma bakımından önem taşırlar. Enzim sistemlerinde veya reaksiyon ortamında organizmalar için mutlak gerekli olan
iz elementlerin iyonlarının bulunması, enzimlerin aktivitelerini arttırmasına karşılık, civa, gümüş gibi ağır metal katyonlarının bulunması aksi tesir yapar. Fakat enzimin aktivite göstermesini engelleyen madde uzaklaştırılınca enzim tekrar etkisini gösterebilir.
Enzimlerin aktivitesinde bilhassa iki faktör rol oynamaktadır.
1. Hidrojen iyonları konsantarasyonu (pH seviyesi)
2. Ortamın sıcaklığı
Enzimlerin etkileri ortamın asitlik derecesine yani hidrojen iyonları konsantrasyonuna bağlıdır. Enzimlerin aktif oldukları pH dereceleri, onun cinsine göre değişiklik göstermekte olup, en fazla aktif olduğu pH derecesine optimal pH denmektedir. 1.2-9.0 pH birimleri dışında genellikle enzimler aktivite göstermemektedirler. Optimal pH derecesi genellikle enzim proteinin,
izo-elektrik noktasındaki ("+" ve "-" yüklü iyonların birbirlerini eşitlediği potansiyelin sıfıra düştüğü nokta) pH derecesidir. pH’dan dolayı enzim aktivitesinin tesirsiz hale gelmesi reversbl bir olay olup pH’nın düzelmesi ile tekrar aktivite kazanılabilmektedir. Ancak çok ekstrem pH dereceleri enzim proteininin
denatüre (kimyasal yapının bozulması) olmasına yol açtığından, enzimin tekrar aktivite göstermesi düşünülemez.
Sıcaklığa gelince; her enzim belli ısı derecelerinde en fazla aktivite göstermektedir, bu ısı derecesine o enzimin optimum ısı derecesi denmektedir. Enzimler ısıya karşı hassastırlar, optimum dereceler aşıldığında aktivite azalmaya başlamakta,
60-100 °C arasında tamamiyle durmaktadır. Bunun nedeni enzim proteininin denatüre olması ve böylece enzimin bozulmasıdır. Bu olay irreversbldir (tersine dönüşü olmayan). Enzimlerin optimum ısısı genellikle 35-55°C arasında bulunmaktadır. Optimum enzim aktivitesini sağlayan sıcaklığa kadar, sıcaklığın her 10 °C yükselmesi ile aktivite iki misli artmaktadır (Van Hoff Kuralı).
Canlı hücrelerden bir kısım enzimleri ekstraksiyonla ayırarak izole etmek mümkünse de, kimyasal yapılarını bulmak çok zordur, çünkü enzimlerde yüksek moleküllü ve çok karışık bileşimde protein unsurları bulunmaktadır. Diğer bir deyimle enzimlerin aktif kısımları izole edilemezler. Toprakta aktiviteleri tayin edilen enzimler, mikroorganizmaların kendi vücut sentezleri için ve organik maddeyi parçalamak üzere dışarı saldıkları ve büyük kısmı toprakta kolloidler tarafından adsorbe edilen, fakat faaliyetlerini şartlara göre sürdürebilen enzimlerdir.
Her enzimin etki yapabildiği belirli bir bileşik grubu olup, bu bileşiklere o enzimin
substratı adı verilmektedir. Böylece enzim, ismini o substrata göre almaktadır. Toprak organik maddeleri çok çeşitli substratları ihtiva ettiğinden, bilinen enzimlerin hemen hepsi toprakta bulunmaktadır. Fakat bunları toprak kolloidlerinden izole ederek, teker teker incelemeye şimdiye kadar geliştirilmiş olan metodlar yeterli değildir. Enzim aktiviteleri, etki etmiş oldukları subtratlarından hidrolize olan madde miktarının ölçülmesi yoluyla tayin edilmekte ve böylece indirekt yolla da teşhisleri yapılmaktadır. Hidrolaz grubu enzimleri, yüksek polimer bileşiklerin molekülleri arasındaki C-O, C-N bağlarına etki ederek, hidroliz yolu ile bu bağları çözerler. Bu gruba dahil olan
esteraz ve lipaz enzimleri ester ve yağları, fosfataz enzimleri fosforik asidin esterlerini, glikozidazlar da oligo ve polisakkaritlerle, glikozitleri hidrolize ederek daha küçük moleküllü basit bileşiklere kadar parçalarlar.
Enzimlerin katalitik etkilerinin mekanizması, tam anlamı ile anlaşılmış ve çözülmüş değildir. Bu hususta ilk akla gelen basit teori, enzimlerin kimyasal reaksiyonları hızlandırdığı, fakat meydana gelen yeni bileşiğin bünyesine dahil olmadıklarıdır. Substrat ve enzim arasında geçici bir kombinasyon mevcuttur. Enzimatik reaksiyonlar, genellikle enzimlerin substrat ile birleşmeleri sonucu, önce bir kompleks teşkil etmeleri ve sonra da bu komplekslerin parçalanması esasına dayanmaktadır. Enzimlerin etkileriyle yürüyen kimyasal reaksiyonlar, diğer bazı kimyasal reaksiyonlar gibi tamamlanmakta ve geriye bir kısım substrat
kalmaktadır. Enzimlerin oluşturdukları reaksiyonların reversbl karakterli olduklarını daha önce belirtmiştik. Enzimatik reaksiyonun hızı ve elde edilen ürünler enzim ve madde miktarlarına bağlı olduğu gibi ortam şartlarına göre değişmektedir.
Enzimler substrattaki bir molekülü, o molekülü oluşturan parçalara ayırdıktan sonra, diğer bir komşu moleküle etki ederek kısa bir süre içinde substratın diğer moleküllerini de hidrolize ederek parçalayabilirler.
Aşağıda birinci resimde enzimin katalizör etkisiyle parçalanma, ikinci resimde ise enzimin katalizör etkisiyle birleşme gözüküyor.
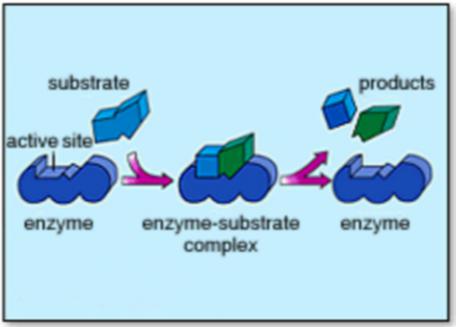
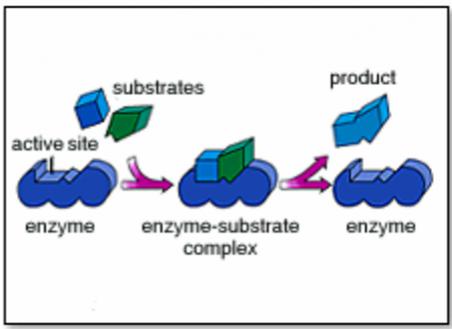
Teorik olarak, enzimatik reaksiyon sonucu oluşan parçalanan ürünler, mikroorganizma ve bitkiler tarafından adsorbe edilmiyecek büyüklükte iseler, başka bir enzim çeşidi bunları daha küçük moleküllü bileşiklere parçalarlar. Diğer bir deyimle, büyük moleküllü bir toprak organik maddesinin, mikroorganizmalar tarafından alınabilir duruma gelmesi için, çeşitli enzimlerin faaliyet göstermesi gerekir.