Yukarda Sn Acemi kil ve katyon değişim kapasitesinden bahsetti. Bu konu çok önemli o yüzden, biraz daha derinlemesine incelemekte fayda var. Bu amaçla önce kilin temel yapı taşları olan yapıyı fiziksel olarak anlamak gerekiyor. Katyon değişiminde önemli bir rolü olan elektrik yükü neden kaynaklanıyor sorusunu inceledikten sonra topraktaki diğer etmenlerle olan etkileşime bakabiliriz. Ama önce kili fiziksel olarak anlayalım. Bu mesajın buna ışık tutmasını umuyorum.
Kum, mil ve kil arasındaki fark tanelerinin büyüklüğüdür.
Kum 2 mm - 0,05 mm (50 mikron)
Mil 50 mikron – 2 mikron
Kil 2 mikronun altı
Kilin temel yapı taşı ya aşağıda gösterilen resim 1’deki bir Silisyum ve dört oksijen atomundan oluşan dört yüzlü yapıdır (tetrahedral yapı) ya da resim 3’deki bir alüminyum ve altı oksijen atomundan oluşan sekiz yüzlü yapıdır (oktahedral yapı). Önce tetrahedral yapıyı açıklayalım: Bu yapı silisyum atomları ile oksijen atomlarının bileşiminden oluşmuştur. Kimyasal olarak atomlar birbirlerine bağlıdırlar. Kimyasal olarak birbirlerine bağlı olmaları bu madde için, her iki elementin atomlarının da biraraya gelerek en dış yörüngelerindeki elektronu ortaklaşa kullanmaları anlaşılmalıdır. Silisyumun atom çekirdeğinin etrafında dolaşan elektronlardan en dış yörüngede 4 elektron mevcuttur. Yani Silisyum bu 4 elektronu başka elementlerle ortaklaşa kullanabilir.
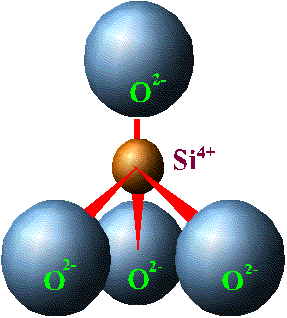
Resim 1
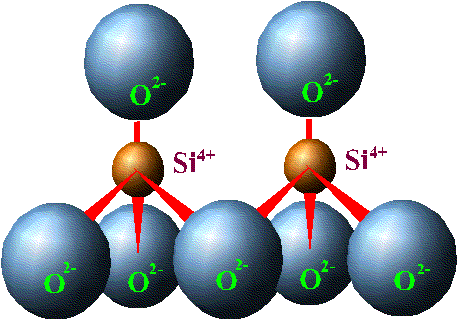
Resim 2
Oksijen atomunun ise en dış yörüngesinde serbestçe dolaşan 2 elektron vardır. Bu yüzden, Silisyumun serbest dolaşan elektronlarını oksijen atomları paylaştıklarında ya da bir silisyum atomu kendi serbest elektronlarını oksijen atomları ile paylaştığında resim 1’de görülen tetrahedral (dört yüzlü) yapı ortaya çıkar (Bu bileşiğin en rahat ettiği yapı budur).
Bu dört yüzlü yapıda 4 oksijen atomunun her biri yalnızca bir elekronunu Silisyum ile paylaşmıştır. Diğer serbest elektronu ise serbest kalmaya devam eder. Aslında bu dört yüzlü yapıyı 3 boyutlu hale getirecek olursanız, ikinci bir silisyum atomunun dört yüzlünün köşelerinden birinde yer alan oksijen atomunun açıktaki diğer elektronunu kullanacağını anlayabilirsiniz. Aynı şey diğer köşelerdeki diğer oksijen atomları için de geçerlidir. Böylece, resim 1’de görülen silisyum atomuna en yakında bulunan diğer 4 adet silisyum atomu her biri şekilde görülen ve oksijene ait fazlalık 4 elektron yükünü kullanırlar ve böylece elektriksel yük dengelenmiş olur. Böylece bu yapı tekrarlanır gider ve bir tetrahedron levhasını (tetrahedron sheet) oluşturur.
Aynı şeyi oktahedral yapı içinde düşünebiliriz (Bakınız resim 3).
Ve oktahedral yapıda da Al atomu boyut olarak 6 oksijen atomunun arasına girmeye uygundur. Ve kimyasal bağ açısından da “en rahat ettiği” konum budur. Burada ise her bir oksijenin 2 olan serbest elektron yükünün sadece 0,5’i, alüminyum ile ortaklaşa kullanılır. 6 oksijen atomu x 0,5 elektron – 3 elektron eder (1 alüminyum atomu yalnızca 3 elektron kullanabilir (+3 olan yükünü nötrlemek için (buna rahatlamak da diyebiliriz)). Geriye kullanılması gereken oksijen başına 1,5 yük daha kalır. (Yoksa oksijen rahatlayamaz!) Oksijen atomlarındaki bu fazlalık yükün dengelenmesi gerekir. Bunu dengelemek için ise, köşelerdeki oksijen atomları yandaki birim hücreye ait başka bir alüminyum atomuyla paylaşılır (resim 4). Böylece yandaki hücrenin ortasında bulunan diğer alüminyum atomunun +3 olan yükü de kendi birim hücresinin dışındaki diğer 6 oksijenden gelecek -3 yükle dengelenecektir. Böylece oksijen atomu başına 6/3 = 0.5 yük daha kullanılmış olur. Geriye oksijen atomlarından ötürü 1 yük kalmış olur (Daha önce 1,5 yük kalmıştı, şimdi de komşu alüminyum atomu içinde 0.5 yük kullanılınca geriye oksijen atomu başına 1 yük kaldı) . Bu yapı 3 boyutta devam ettiğinde oktahedral levha oluşur. Eğer fazlalık yükten ötürü H proton ile dengelenirse (proton artı yüklü olduğu için oksijenin ihtiyacı olan rahatlığı sağlayacaktır) gibsit minerali oluşur. Ama yük dengeleri açısından bakıldığında gibsit mineralinin oluşmasına bir alternatif daha vardır.
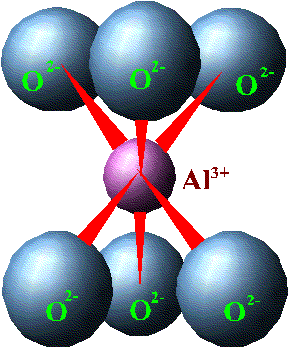
Resim 3
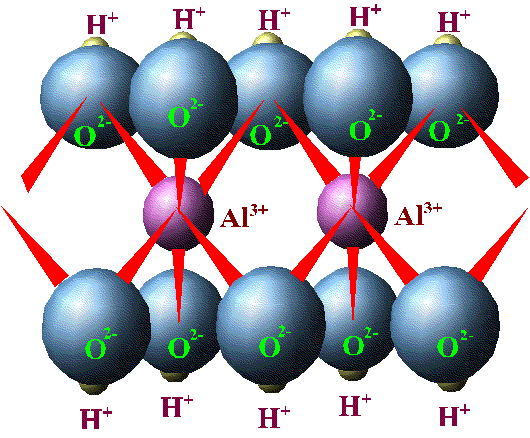
Resim 4
Silisyum oksidin dört yüzlü birim hücresini incelerken dengelenmemiş elektrik yükü olduğundan bahsetmiştim. Oktahedral tabaka da eğer bir tarafındaki yükünü protonla dengeleyerek gibsit minerali oluşturmamış ise, Proton-Oktahedron-Tetrahedron tabakaları bir araya gelerek yine yük dengesini sıfırlayarak yeni bir levha oluşturabilirler (resim 5). Bunun adı da kaolinit’tir. Bu açıklamayı burada bırakmayı uygun görüyorum. Diğer mineral türlerinin de çeşitli kombinasyonlarla oluşması söz konusu. Çünkü asıl anlatmak istediğim konu bundan sonra.
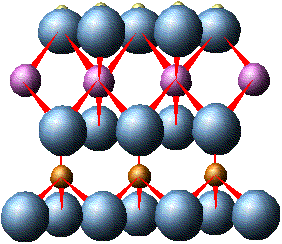
Resim 5
Moleküler boyuttaki bu Silisyum oksit ve alümniyum oksitten oluşan tabakalara
levha (sheet) diyoruz. (Devamı var)